ИССЛЕДОВАНИЕ УСЛОВИЙ ВЫДЕЛЕНИЯ И ОЧИСТКИ ГЛЮКОАМИЛАЗЫ ИЗ SACCHAROMYCES CEREVISIAE ЛВ-7
Анализ данных литературы указывает на многообразие комбинаций используемых авторами методов получения амилолитических препаратов с высокой степенью чистоты [8, 11]. В этой связи мы изучили влияние на эффективность выделения и очистки глюкоамилазы из Saccharomyces cerevisiae ЛВ-7 различных органических растворителей, а также условий хроматографирования.
Культивирование продуцента проводили в лабораторных условиях в два этапа. Сначала дрожжи выращивали твердофазным способом в чашках Петри в течение 48 ч при температуре 26-27 С и рН субстрата 4,7-5,0, используя в качестве питательной среды агар-агар и солодовое неохмеленное сусло (8% сухого вещества). На втором этапе полученный инокулят вносили в колбы в мелассную среду (меласса - 10% сухого вещества) и осуществляли культивирование глубинным методом в течение 24 ч при температуре 30-32 С и рН субстрата 4,7-5,0. Готовую биомассу продуцента сушили 3-4 дня при 25-27 С, измельчали до порошкообразного состояния. Для разрушения клеточной стенки и перевода глюкоамилазы в раствор дрожжи тщательно растирали с песком или измельченным стеклом.
Экстpaкцию фермента проводили ацетатным буфером с рН 4,7 при постоянном перемешивании в течение 1,5-2,0 ч при температуре 20-22 С из 5% раствора дрожжей. Для концентрирования экстpaкта культуры дрожжей S. cerevisiae проводили ультрафильтрацию на мембране УФМ-50. Каталитическую активность глюкоамилазы определяли глюкозооксидазным методом реагентами "Оксохром Глюкоза С" ("Lachema", Чехия),. содержание белка в препарате по методу Лоури [7]. Очистку фермента от низкомолекулярных примесей осуществляли методом гельхроматографии на сефадексе G-25, от высокомолекулярных на сефадексе G-150. Контроль гомогенности глюкоамилазы проводили путем электрофореза в полиакриламидном геле (ПААГ) по методу Дэвиса [3]. Окрашивание белковых полос осуществляли, используя нитрат серебра [14].
Известно, что белковые молекулы в присутствии органических растворителей способны образовывать агрегаты и выпадать в осадок, так как сила электростатического притяжения обратно пропорциональна диэлектрической постоянной среды, которая в данном случае уменьшается [1,2]. В этой связи нами было изучено влияние различных концентраций (50,0-83,3%) ацетона, изопропилового и этилового спиртов на эффективность осаждения глюкоамилазы.
Анализ литературы показал, что при комнатной температуре большинство ферментов быстро денатурируется органическими растворителями [1, 7, 10]. Низкая температура не только пpeдoxpaняет фермент от инактивации, но и усиливает осаждающее действие растворителей. Поэтому культуральную жидкость охлаждали до 2 С, органические растворители - до -6 С. Внесение осадителя в экстpaкт фермента проводили при постоянном перемешивании, поместив колбу в емкость со льдом. Далее осуществляли центрифугирование при 3000 g в течение 15 минут, полученный осадок растворяли в минимальном объеме ацетатного буфера (рН 4,7) для снижения в препарате концентрации органического растворителя.
Результаты экспериментов свидетельствуют о том, что использование органических растворителей в диапазоне концентраций 50,0-83,3% по-разному отражается на выходе глюкоамилазы и величине ее удельной активности.
Выявлено, что максимальный выход фермента 38,6% наблюдается после осаждения изопропиловым спиртом в концентрации 80,0%, что на 1,5% больше по сравнению с действием этилового спирта и на 5,7% превышает данную величину для ацетона.
При более низких значениях концентрации органических растворителей процент выхода глюкоамилазы понижается незначительно, однако, удельная активность составляет лишь 30% от максимальной величины. Высокие концентрации осадителей (83,3%) снижают каталитическую активность глюкоамилазы и уменьшают выход фермента на 5%. Следовательно, осаждение глюкоамилазы из культуральной жидкости дрожжей S. сerevisiae ЛВ-7 целесообразно осуществлять с помощью 80,0% изопропилового спирта, т.к. именно в этом случае выход фермента максимален (38,6%), а удельная активность достаточно высокая (0,43 ед/мг).
Результаты наших экспериментов хорошо согласуются с данными литературы. Показана высокая эффективность применения изопропилового спирта для выделения амилолитического комплекса из экстpaкта поверхностной культуры Aspergillus oryzae [4, 13].
Получение ферментных препаратов основано на осаждении белка путем дегидратации его мицелл и снятия заряда гидрофильной молекулы органическими растворителями или нейтральными солями. При этом важную роль играет начальная величина концентрации ионов водорода ферментной вытяжки. Известно, что из одного и того же раствора при различных значениях рН можно получить неодинаковый выход осадков, содержащих разное количество фермента [1, 7]. Это связано с наиболее полным осаждением фермента при величине рН, соответствующей изоэлектрической точке данного белка. Так как для глюкоамилазы из дрожжей S. cerevisiae ЛВ-7 подобные данные отсутствуют, мы проводили осаждение изопропанолом в концентрации 80,0% из экстpaктов, приготовленных на ацетатном буфере с диапазоном значений рН 3,5-6,0.
Обнаружено, что наибольший выход глюкоамилазы (37,3%) наблюдается в интервале величин рН 4,5-5,0 с максимумом при рН 4,7. В этом же диапазоне значений концентрации ионов водорода в среде фермент проявляет высокую каталитическую активность, максимальная величина которой зафиксирована при рН 4,7 и составляет 0,42 ед/мг, что вполне согласуется с данными литературы [6, 9, 15].
С целью выявления оптимальной для выделения глюкоамилазы концентрации культуральной жидкости дрожжей фермент осаждали 80% изопропиловым спиртом из экстpaктов с 5-30% содержанием продуцента.
Установлено, что максимальные выход фермента и удельная активность (0,42 ед/мг) наблюдаются при 5% концентрации дрожжей в экстpaкте. С увеличением процента содержания продуцента в культуральной жидкости в осадок увлекается все большее количество балластных белков, что приводит к снижению выхода глюкоамилазы и уменьшению ее каталитической активности.
Таким образом, выделение глюкоамилазы целесообразно осуществлять 80% изопропиловым спиртом из 5% экстpaкта дрожжей, приготовленного на основе ацетатного буфера с рН 4,7.
Нами показано, что для осаждения глюкоамилазы из культуральной жидкости требуются большие объемы органического растворителя (1 объем экстpaкта : 4 объема изопропанола). Известно, что ультрафильтрация позволяет концентрировать и очищать от балластных соединений растворы высокомолекулярных веществ [12]. Для этого применяют полупроницаемые мембраны (ацетатцеллюлозные, на полиамидной основе и др.), обладающие способностью селективно пропускать различные компоненты фильтруемой жидкости. С целью концентрирования приготовленный 5% экстpaкт культуры дрожжей S. cerevisiae ЛВ-7 подвергали ультрафильтрации на мембране УФМ-50 (диаметр пор 0,05 мкм). Установлено (табл. 1), что в фильтрат переходит незначительное количество глюкоамилазы (около 2%). Культуральная жидкость была сконцентрирована в 3 раза, удельная активность фермента возросла в 6 раз, резко увеличился выход энзима по активности (со 100 до 274,8%). Из полученного концентрата глюкоамилазу осаждали 80% изопропиловым спиртом. Степень очистки фермента на данной стадии составляла 9,14, а удельная активность - 1,92 ед/мг. В связи с невысоким содержанием белка в полученном препарате (39,2 мг) высаливание сульфатом аммония не осуществляли.
Гель-фильтрация на сефадексе G-25 позволила увеличить степень очистки глюкоамилазы до 41,1. Уменьшение содержания белка, более чем в 14 раз, указывает на эффективное освобождение фермента от низкомолекулярных белков (например, альбуминов с Мr = 16-32 кДа) и других примесей.
Заключительной стадией очистки глюкоамилазы была гель-хроматография на сефадексе G-150.
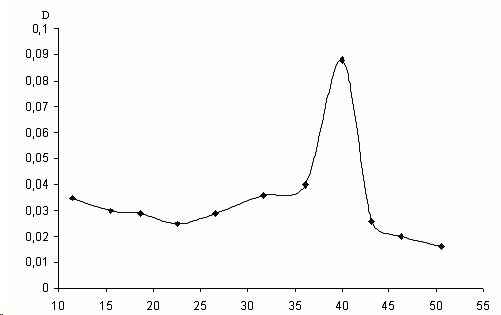
Элюцию фермента осуществляли ступенчато цитратно-фосфатным буфером (рН 4,7) со скоростью 12 мл/ч. Элюат собирали порциями по 3 мл и определяли в каждой из них количество белка и каталитическую активность глюкоамилазы, наиболее активные фpaкции объединяли. Выход глюкоамилазы представлен одним пиком (рис.
1).В интервале объемов выхода 20-30 мл происходило элюирование балластных белков, так как каталитической активностью данные фpaкции не обладали. Таким образом, нами был получен ферментный препарат глюкоамилазы с 70-кратной степенью очистки, удельной активностью 14,8 ед/мг (табл. 1).
Рис.1. Профиль эволюции глюкомилазы, выделенной из VQ ,мл Saccharomyses, с колонки, упакованной сефадексом G-150
Таблица 1. Очистка глюкоамилазы из дрожжей Saccharomyces cerevisiae ЛВ-7
|
Стадия очистки |
Общая активность, ФЕ |
Количество белка, мг |
Удельная активность, ед/мг |
Степень очистки |
Выход, % |
|
Культуральная жидкость |
3628,8 22,7 |
384,0 |
0,21 0,01 |
1 |
100,0 |
|
Ультрафильтрация на УФМ-50 |
9972,0 37,4 |
554,0 |
1,20 0,03 |
5,7 |
274,8 |
|
Осаждение изопропиловым спиртом |
752,6 6,9 |
39,2 |
1,92 0,06 |
9,14 |
20,7 |
|
Гель-фильтрация на сефадексе G-25 |
580,6 5,2 |
11,2 |
8,64 0,12 |
41,1 |
16,0 |
|
Гель-хроматография на сефадексе G-150 |
142,1 2,1 |
1,6 |
14,8 0,22 |
70,5 |
4,0 |
Для определения молекулярной массы фермент наносили на колонку с сефадексом G-150 вместе с маркерными белками: каталазой (Мr=200 кДа), бычьим сывороточным альбумином (Мr=68 кДа), интерфероном (Мr=22 кДа), цитохромом С (Мr=13 кДа) и инсулином (Мr=6 кДа). На основе полученных данных строили калибровочную прямую зависимости lg Мr маркерных белков от объемов выхода (Ve), по которой и была определена кажущаяся молекулярная масса глюкоамилазы, равная 99,8 кДа, что вполне согласуется с данными литературы [1, 5, 6].
Проведенный электрофоретический анализ в ПААГ показал гомогенность полученного препарата глюкоамилазы из S. сerevisiae ЛВ-7.
Литература
- Галич И.П. Амилаза микроорганизмов. Киев.: Наук. думка. 1987. 192 с.
- Диксон М., Уэбб Э. Ферменты. М.: Мир. 1982. Т. 1. 389 с.
- Землянухин А.А. Большой пpaктикум по физиологии и биохимии растений. Учеб. пособие. Воронеж: Изд-во Воронежск.. ун-та. 1996. 188 с.
- Калашников Е.Я. Производство амилолитических и протеолитических ферментов и применение их в пивоваренной промышленности. М.: ГосИНТИ. 1959. 24 с.
- Квеситадзе Г.И. Грибные и бактериальные амилазы. Тбилиси.: Мецниереба. 1984. 154 с.
- Котова Г.А., Котов В.Б., Сорокина А.С. Глюкоамилаза микроорганизмов. М.: Пищепромиздат. 1975. 41 с.
- Кочетов Г.А. Пpaктическое руководство по энзимологии. М..: Высш. шк. 1980. 272 с.
- Нестеренко М.В., Кузавлев В.А., Мосолов В.В. // Прикл. биохим. и микробиол. 1990. Т. 26. Вып. 5. С. 598.
- Савельев А.Н., Яковлева М.Ф., Фирсов Л.Н. // Биохимия. 1984. Т. 49. Вып. 11. С. 1754.
- Степанов В.М. Молекулярная биология. Структура и функции белков. М.: Высш. шк. 1996. 335 с.
- Ташмухамедова Ш.С., Хасанов Х.Т., Рахимов М.М. // Прикл. биохим. и микробиол. 1995. Т. 31. Вып. 3. С. 272.ё
- Яровенко В.В. Концентрирование ферментных растворов методом ультрафильтрации. М.: ОНТИТЭИ Микробиопром. 1978. 36 с.
- Fogarty W.M., Bourke E.J. // J. Chem. Tech. and Biotechnol. 1983. Vol. 338. P. 145.
- Nesterenko M.V., Tilley M., Upton S.J. // J. Biochem. Biol. 1994. Vol. 28. P. 239.
- Pazur J.H., Lui B., Bishel F. // Biotechnol. and Appl. Biochem. 1990. Vol. 12. № 1. P. 63.
 Статья в формате PDF
139 KB...
Статья в формате PDF
139 KB...
02 05 2024 13:22:43
 Статья в формате PDF
323 KB...
Статья в формате PDF
323 KB...
01 05 2024 22:32:20
 Статья в формате PDF
100 KB...
Статья в формате PDF
100 KB...
30 04 2024 11:26:22
 Статья в формате PDF
125 KB...
Статья в формате PDF
125 KB...
28 04 2024 22:50:34
 Статья в формате PDF
124 KB...
Статья в формате PDF
124 KB...
27 04 2024 13:52:40
 Статья в формате PDF
250 KB...
Статья в формате PDF
250 KB...
26 04 2024 3:28:57
25 04 2024 9:11:12
 Обсуждены методика и некоторые результаты моделирования вероятных конфигураций межфазных границ на поверхности композиционных материалов, полученные методом итерации треугольных генераторов на определенных сетках Кеплера-Шубникова.
...
Обсуждены методика и некоторые результаты моделирования вероятных конфигураций межфазных границ на поверхности композиционных материалов, полученные методом итерации треугольных генераторов на определенных сетках Кеплера-Шубникова.
...
24 04 2024 22:59:33
 Статья в формате PDF
317 KB...
Статья в формате PDF
317 KB...
23 04 2024 14:55:34
22 04 2024 16:30:45
 Статья в формате PDF
233 KB...
Статья в формате PDF
233 KB...
20 04 2024 9:31:32
 Статья в формате PDF
100 KB...
Статья в формате PDF
100 KB...
19 04 2024 15:32:46
 Статья в формате PDF
125 KB...
Статья в формате PDF
125 KB...
18 04 2024 2:26:48
 Статья в формате PDF
284 KB...
Статья в формате PDF
284 KB...
17 04 2024 12:49:34
 Статья в формате PDF
268 KB...
Статья в формате PDF
268 KB...
16 04 2024 2:49:11
 Статья в формате PDF
110 KB...
Статья в формате PDF
110 KB...
12 04 2024 1:58:50
 Статья в формате PDF
109 KB...
Статья в формате PDF
109 KB...
11 04 2024 0:46:59
 Статья в формате PDF
295 KB...
Статья в формате PDF
295 KB...
10 04 2024 20:22:55
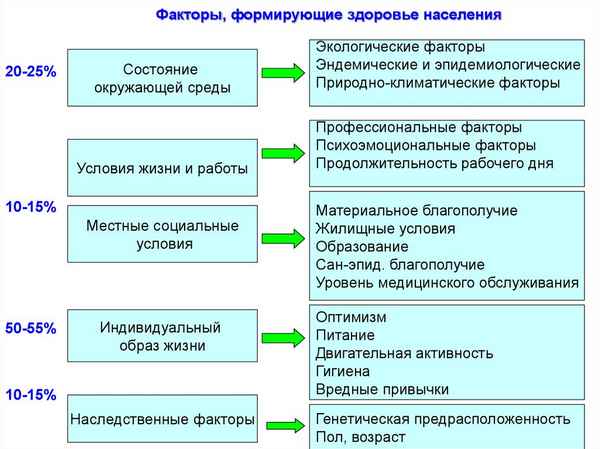 Артериальная гипертония является одним из главных факторов риска атеросклероза и ишемической болезни сердца (ИБС). Путем сплошного скрининга двух сельских районов проведен анализ распределения показателей артериального давления (АД) в популяции. Исследован хаpaктер питания как фактор риска развития атеросклероза. Был проведен поиск генетических маркеров указанных заболеваний. Показано, что факторами пониженного риска ИБС является носительство аллелей гена АроВ30 и АроВ34, а носительство аллеля е4 АроЕ, аллеля Д и генотипа ДД - факторы повышенного риска данной патологии.
...
Артериальная гипертония является одним из главных факторов риска атеросклероза и ишемической болезни сердца (ИБС). Путем сплошного скрининга двух сельских районов проведен анализ распределения показателей артериального давления (АД) в популяции. Исследован хаpaктер питания как фактор риска развития атеросклероза. Был проведен поиск генетических маркеров указанных заболеваний. Показано, что факторами пониженного риска ИБС является носительство аллелей гена АроВ30 и АроВ34, а носительство аллеля е4 АроЕ, аллеля Д и генотипа ДД - факторы повышенного риска данной патологии.
...
09 04 2024 3:10:32
 Статья в формате PDF
244 KB...
Статья в формате PDF
244 KB...
08 04 2024 12:11:12
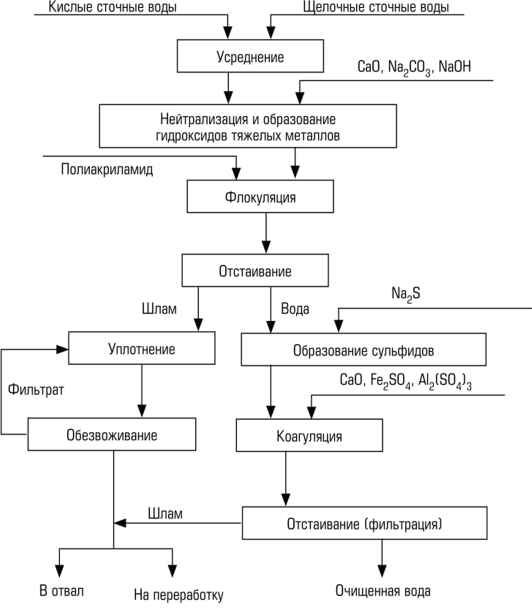 Статья в формате PDF
227 KB...
Статья в формате PDF
227 KB...
07 04 2024 14:20:10
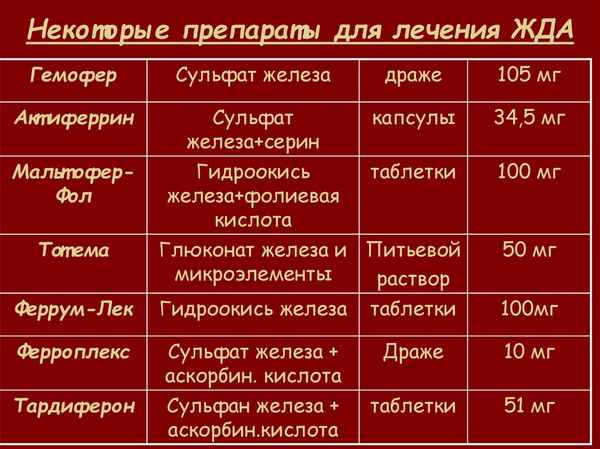 Статья в формате PDF
114 KB...
Статья в формате PDF
114 KB...
06 04 2024 2:37:53
 Статья в формате PDF
101 KB...
Статья в формате PDF
101 KB...
05 04 2024 23:52:15
 Статья в формате PDF
113 KB...
Статья в формате PDF
113 KB...
04 04 2024 4:17:21
 Статья в формате PDF
133 KB...
Статья в формате PDF
133 KB...
02 04 2024 1:21:13
 Статья в формате PDF
117 KB...
Статья в формате PDF
117 KB...
01 04 2024 6:33:33
 Статья в формате PDF
295 KB...
Статья в формате PDF
295 KB...
30 03 2024 2:14:19
 В статье представлен результат первого в Забайкалье опыта использования в травматологической пpaктике систем трaнcпедикулярной фиксации позвоночника. Проанализировано 12 случаев успешного применения метода.
...
В статье представлен результат первого в Забайкалье опыта использования в травматологической пpaктике систем трaнcпедикулярной фиксации позвоночника. Проанализировано 12 случаев успешного применения метода.
...
28 03 2024 3:57:10
 Статья в формате PDF
111 KB...
Статья в формате PDF
111 KB...
27 03 2024 11:15:56
 Статья в формате PDF
110 KB...
Статья в формате PDF
110 KB...
26 03 2024 1:26:52
 Статья в формате PDF
307 KB...
Статья в формате PDF
307 KB...
25 03 2024 5:54:53
 Статья в формате PDF
105 KB...
Статья в формате PDF
105 KB...
24 03 2024 17:27:29
Еще:
Поддержать себя -1 :: Поддержать себя -2 :: Поддержать себя -3 :: Поддержать себя -4 :: Поддержать себя -5 :: Поддержать себя -6 :: Поддержать себя -7 :: Поддержать себя -8 :: Поддержать себя -9 :: Поддержать себя -10 :: Поддержать себя -11 :: Поддержать себя -12 :: Поддержать себя -13 :: Поддержать себя -14 :: Поддержать себя -15 :: Поддержать себя -16 :: Поддержать себя -17 :: Поддержать себя -18 :: Поддержать себя -19 :: Поддержать себя -20 :: Поддержать себя -21 :: Поддержать себя -22 :: Поддержать себя -23 :: Поддержать себя -24 :: Поддержать себя -25 :: Поддержать себя -26 :: Поддержать себя -27 :: Поддержать себя -28 :: Поддержать себя -29 :: Поддержать себя -30 :: Поддержать себя -31 :: Поддержать себя -32 :: Поддержать себя -33 :: Поддержать себя -34 :: Поддержать себя -35 :: Поддержать себя -36 :: Поддержать себя -37 :: Поддержать себя -38 ::