БЕЛКИ ЭРИТРОЦИТОВ. МИНИОБЗОР
1 Государственный медицинский университет В миниобзоре приведены сведения об основных результатах исследования эритроцитарных белков. Обсуждается строение и функции комплексов белка 4.1.R и белка 3 полосы, результаты исследованиябелков – трaнcпортеров, включая роль аквапорина 1 в трaнcпорте двуокиси углерода. Обсуждается представления о механизме Gárdos эффекта в эритроцитах. Приведены сведения об интеpaктоме белков цитозоля эритроцитов. Обсуждаются вопросы развития окислительного стресса в эритроцитах включая, роль белка пероксиредоксина 2. Показано участие гемоглобина в механизмах старения эритроцитов. Статья в формате PDF 287 KB эритроцитыбелкигемоглобинокислительный стресс 1. Миндукшев И.В., Кривошлык В.В., Добрылко И.А. и др. // Биологические мембраны. – 2012. – Т.27, № 1. – С. 23–28. 2. Barvitenko N.N., Adragna N.C., Weber R.E. Erythrocyte Signal Transduction Pathways, their Oxygenation Dependence and Functional Significance // Cell Physiol Biochem – 2005. – № 15. –P. 1–18. 3. Baines A.J. Evolution of spectrin function in cytoskeletal and membrane networks // Biochem Soc Trans. – 2009. – Vol. 37(Pt 4). – P. 796–803. 4. Blank ME, Ehmke H. Aquaporin-1 and HCO3(-)-Cl- transporter-mediated transport of CO2 across the human erythrocyte membrane // Physiol. – 2003. – Vol. 550(Pt 2). – P. 419–429. 5. Brazhe N.A., Abdali S, Brazhe A.R., Luneva O.G. et al. //Biophys J. – 2009. – Vol. 97(12). – P. 3206–3214. 6. Bruce L.J., Beckmann R., Ribeiro M.L., Peters L.L. et al. // Blood. – 2003. – Vol. 101, № 10. – P. 4180–4188. 7. Burak Çimen M.Y. Free radical metabolism in human erythrocytes // Clinica Chimica Acta. – 2008. – Vol. 390, № 1–2. –P. 1–11. 8. Blodgett DM, Graybill C, Carruthers A. ***ysis of glucose transporter topology and structural dynamics // J Biol Chem. – 2008. – № 283: 36416–36424. 9. Campanella M.E., Chu H., Low P.S. Assembly and regulation of a glycolytic enzyme complex on the human erythrocyte membrane // PNAS. – 2005. –Vol. 102, № 7. – P. 2402–2407. 10. Davies J.A. Degradation of oxidized proteins by the 20S proteasome // Biochimie. – 2001. – Vol. 83. – P. 301–310. 11. D’Alessandro A, Righetti PG, Zolla L. The red blood cell proteome and interactome: an update // Proteome Res. – 2010. – Vol. 9 (1). – P. 144–163. 12. Endeward, V., Musa-Aziz, R., Cooper, G. J., Chen, L. et al. // The FASEB Journal. – 2006. – Vol. 20, № 12. – P. 1974–1981. 13. Gauthier E, Guo X, Mohandas N, An X. Phosphorylation-dependent perturbations of the 4.1R-associated multiprotein complex of the erythrocyte membrane // Biochemistry. – 2011. –Vol. 50(21). – P. 4561–4567. 14. Goodman S.R. Kurdia A., Ammann L., Kakhniashvili D., Daescu O. // Exp Biol Med. – 2007. – Vol. 232, №11. – P. 1391–1408 15. Ian A. Lewis, M. Estela Campanella, John L. Markley and Philip S. Low Role of band 3 in regulating metabolic flux of red blood cells // PNAS. – 2009. –Vol. 106, № 44. – P. 18515–18520. 16. Lang P.A., Kaiser S., Myssina S., Wieder T., Lang F., Huber S.M. // Am J Physiol Cell Physiol. – 2003. – Vol. 285(6). –P. 1553–1560. 17. Lang F., Lang K.S., Wieder T., Myssina S. et al. // Pflugers Arch. – 2003. – Vol. 447(2). – P. 121–125. 18. Li H.T., Feng L., Jiang W.D., Liu Y. et al. // Aquat Toxicol. – 2013. –Vol. 126. – P. 169–179. 19. Low F.M., Hampton M.B., Peskin A.V., Winterbourn C.C. Peroxiredoxin 2 functions as a noncatalytic scavenger of low-level hydrogen peroxide in the erythrocyte // Blood. – 2007. –Vol. 109(6). – P. 2611–2617. 20. Low F.M., Hampton M.B., Winterbourn C.C. Peroxiredoxin 2 and peroxide metabolism in the erythrocyte // Antioxid Redox Signal. – 2008. – Vol. 10(9). – P. 1621–1630. 21. Mairbäurl H., Weber R.E. Oxygen Transport by Hemoglobin // Physiol. – 2012. – Vol. 2. – P. 1463–1489. 22. Maher A.D., Kuchel P.W. The Gárdos channel: a review of the Ca2 + -activated K + channel in human erythrocytes // Int J Biochem Cell Biol. – 2003. – Vol. 35(12). – P. 1182–1197. 23. Manno S., Takakuwa Y., Mohandas N. Modulation of erythrocyte membrane mechanical function by protein 4.1 phosphorylation. // J Biol Chem. – 2005. – Vol. 280. – P. 7581–7582. 24. Manta B., Hugo M, Ortiz C., Ferrer-Sueta G., Trujillo M., Denicola A. // Arch Biochem Biophys. – 2009. – Vol. 484(2). – P. 146–154. 25. Matarrese P., Straface E., Pietraforte D., Gambardella L., et al. // FASEB J. – 2005. – Vol. 19, № 3. – P. 416–418. 26. Metere A, Iorio E, Pietraforte D, Podo F, Minetti M. Arch Biochem Biophys. – 2009. – Vol. 484(2). – P. 173–82. 27. Neelam S., Kakhniashvili D.G., Wilkens S., Levene S., Goodman S.R. // Exp Biol Med – 2011. – Vol. 236, № 5. – P. 580–591. 28. Nunomura W., Takakuwa Y., Parra M., Conboy J. Mohandas N. // J. Biol. Chem. – 2000. – Vol. 275. – P. 24540–24546. 29. Nunomura W., Takakuwa Y. Regulation of protein 4.1R interactions with membrane proteins by Ca2 + and calmodulin // Front Biosci. – 2006. – Vol. 11. – P. 1522–1539. 30. Puchulu-Campanella E, Chu H, Anstee D.J et al. // J.Biol Chem. – 2013. – Vol. 288(2). – P. 848–858. 31. Takakuwa Y. Protein 4.1, a multifunctional protein of the erythrocyte membrane skeleton: structure and functions in erythrocytes and nonerythroid cells. // Int J Hematol. – 2000. – Vol. 72(3). – P. 298–309. 32. Rinehart J., Gulcicek E.E., Joiner C.H., Lifton R.P., Gallagher P.G. // Curr Opin Hematol. –2010. – Vol. 17(3). – P. 191–197. 33. Rocha S., Costa E., Coimbra S., Nascimento H. et al. //Blood Cells Mol Dis. – 2009. – Vol. 43(1). – P. 68–73. 34. Salomao M., Zhang X., Yang Y., Lee S. et al. //Proc Natl Acad Sci. – 2008. – Vol. 10, № 105(23). – P. 8026–8031.
Достижения протеомики существенно расширили наши представления об индивидуальных белках, строении и функциях макромолекулярных белковых комплексах в эритроцитах. На мембране эритроцитов обнаружены макромолекулярные ассоциаты, которые названы комплекс белка 4.1.R и комплекс белка 3 полосы. Предложена модель организации макромолекулярного комплекса цитоскелетных и трaнcмембранных белков с участием белка 4.1 R. По горизонтали белок 4.1 R. взаимодействует с актином, спектрином и белком p55, причем последний определяет узловые соединения между мембраной и компонентами цитоскелета. По вертикали белок 4.1 R взаимодействует с цитоплазматическим доменом трaнcмембранного белка гликофорина С, белком 3 полосы и CD44, что создает своего рода мостик между сетью белков и мембранным бислоем [28]. Основная функция комплекса белка 4.1 R – определение механических свойств и деформируемость мембран эритроцитов. Высказано предположение, что нарушения этого комплекса детерминируют не только нестабильность эритроцитарных мембран, но и ремоделирование поверхности красных клеток. [13; 30; 33]. Проводятся исследования по выявлению факторов, регулирующих множественные белок – белковые взаимодействия в комплексе белка 4.1 R. Одним из таких факторов является фосфорилирование белка 4.1 R с участием протеинкиназы С. В результате снижается способность белка 4.1 R образовывать комплекс со спектрином и актином, диссоциация от гликофорина С, что приводит к изменению механических свойств мембран эритроцитов [22;27]. Высказано мнение, что эластичность мембраны эритроцитов в большей степени зависит от динамической перестройки комплекса димеры спектрина/тетрамеры спектрина по влиянием сдвига напряжения в кровотоке [3].
Белок 3 полосы формирует основу (кор) для макромолекулярного комплекса интегральных и периферических белков мембраны эритроцитов. Первоначально было предположено, что этот комплекс функционирует как интегрированная структурная единица (метаболон) для обмена CO2/O2 в эритроцитах [6]. Более поздними исследованиями показано, что тетрамер белка 3 полосы связан с анкирином, который, в свою очередь, взаимодействует со спектрином. Tрaнcмембранные гликопротеины GPA, Rh, RhAG связываются с белком 3 полосы, тогда как CD47 and LW взаимодействуют с Rh/RhAG. Два цитоплазматических домена белка 3 полосы имеют сайты связывания растворимых белков. Причем большой N –концевой терминальный домен имеет сайты связывания как для дезоксигемоглобина, так и для ряда ферментов гликолиза (глицеральдегид-3-фосфатдегидрогеназа и альдолаза). Предположительно, взаимодействие ферментов гликолиза с доменом белка 3 полосы проходит при участии стыковочных белков. С-терминальный участок связывает карбоангидразу II. Связывание карбоангидразы II приводит к двум событиям: поглощению углекислого газа и высвобождение кислорода из гемоглобина. В условиях высокой оксигенации связывание гликолитических ферментов с белком 3 полосы ингибирует гликолиз при усилении пентозофосфатного пути. В условиях низкой оксигенации взаимодействие дезоксигемоглобина с белком 3 полосы приводит к усилению гликолиза и снижению пентозофосфатного пути. Расширены представления о роли 2, 3 –дифосфоглицерата. Этот метаболит взаимодействует с комплексом спектри-актин-белок 4.1, способствует взаимодействию с комплексом спектрин-антин-белок 4.1 [2; 5; 9,14;29].
Получены новые данные о мембранных белках – трaнcпортерах. Наряду с известными трaнcпортерами, такими как Nа+, К+-АТФ-аза и Са2+-АТФ-аза, показано присутствие Na+/K+/2Cl− кo-трaнcпортера и трaнcпортера глюкозы. Относительно последнего мнения расходятся. По одним представлениям, трaнcпортер глюкозы представлен GLUT1 1 [8], по другим – GLUT1, GLUT3, GLUT4 [7]. Есть сведения об участии в переносе глюкозы гликофорина А [1]. Также было предположено наличие других трaнcпортеров, в частности, водород-лактат котрaнcпортера. Приведены данные, подтверждающие наличие белка – трaнcпортера XK, участвующего в переносе аминокислот и олигопептидов [7].
В мембранах эритроцитов обнаружено присутствие аквапорина 1. Blank ME и Ehmke H. показали, что не только HCO3(-)-Cl– трaнcпортер, но и аквапорин 1 эритроцитов непосредственное принимает участие в трaнcпорте двуокиси углерода через мембрану эритроцита [4]. Endeward V. привели данные, демонстрирующие, что через аквопорин 1 переносится до 60 % углекислого газа, что позволяет рассматривать аквопорин как основной путь поступления CO2 в эритроцит [12.]
Для эритроцитов обнаружен феномен выхода ионов калия (Ca(2+)-dependent K(+) efflux). Ответственным за этот эффект (Gárdos effect) является специфический кaнaльный мембранный белок (Gárdos channel), активатором которого являются ионы кальция [17]. Одной из функций Ca(2+)-dependent K(+) каналов является их участие в регуляции апоптоза эритроцитов [15;21]. Начато изучение функции неселективных катионных каналов в регуляции объема клетки. По представлениям Lang F и соавт. [16]. в эритроцитах человека неселективные катионные каналы открываются при осмотическом сморщивании клеток. Также среди стимуляторов активации каналов называют окислительный стресс и гипоэнергетическое состояние. Катионные каналы проницаемы для кальция и их открытие приводит к увеличению уровня кальция в цитозоле. Ионы кальция, поступающие через катионный канал, стимулируют активацию скрамблазы, что ведет к разрушению асимметрии фосфатидилсерина в мембранах эритроцитов и стимулирует Ca(2+)-зависимый выход K(+), что приводит к потере ионов калия и сморщиванию клеток. Нарушение асимметрии фосфатидилсерина подтверждается связыванием аннексина, что является признаком апоптозных клеток. Экспозиция фосфатидилсерина на внешней стороне мембраны эритроцитов стимулирует фагоциты к поглощению апоптозных эритроцитов [16].
Rinehart J и соавт. высказали мнение, что KCl котрaнcпорт и активация Gardos каналов играет большую роль в регуляции водно-солевого баланса в эритроцитах [31].
В цитозоле эритроцитов содержится большое количество белков. По данным [11], с помощью протеомных технологий идентифицирован 751 белок. Это позволило определить степень взаимодействия и взаимного влияния этих белков (интеpaктом). Обращает внимание наличие определенных кластеров, один из которых авторы [11] назвали ROD Box (Repair Or Destroy). Этот бокс содержит белки, которые, используя энергию АТФ, участвуют в рефолдинге поврежденных белков. В состав этого бокса входят шапероны и белки протеасомных субъединицы, белки теплового шока [11, 14]. Исследованием [26] показано наличие действующих 20S протеосом (независимых от АТФ и убиквитина) в зрелых эритроцитах. Авторы ставят закономерный вопрос о причинах сохранения этих протеосом в зрелых эритроцитах. Высказано предположение, что 20S протеасомы более устойчивы к окислительному стрессу [10]. Другим вопросом является существование убиквитинзависимой претолитической деградации белков в эритроцитах.
Присутствие в мембранах полиненасыщенных жирных кислот, среда, богатая кислородом и содержащая железо, делает эритроциты подверженными окислительному стрессу. Источником АФК в эритроцитах является аутоокисление гемоглобина, в результате образуется супероксиданионы (O2•−). При этом гемоглобин превращается метгемоглобин. Кроме супероксиданионов образуется пероксид водорода и другие активные формы кислорода (реакции Габера-Вейса и Фентона). Активные формы кислорода индуцируют активацию перекисного окисления липидов, окислительное повреждение белков эритроцитов, т.е. способствуют развитию окислительного стресса.
Образование МДА способствует формированию перекрестных сшивок между фосфолипидами и белками мембраны. Результатом является нарушение функции мембраны, деформабильности клетки и ограничение жизни эритроцита. Наиболее чувствительны к образованию МДА белки – трaнcпортеры ионов и белок 3 полосы, а также глицероальдегид-3 – фосфатдегидрогеназа и фосфофруктокиназа. Предполагается, что критичным звеном для выживания эритроцита является окислительное повреждение Са2 + АТФ-зы [1; 7]. Увеличение образования пероксида водорода способствует увеличению метгемоглобина, ПОЛ и комплексов спектрин – гемоглобин. При взаимодействии супроксиданионов с оксидом азота образуется пероксинитрит. Пероксинитрит вызывает множественные внутриэритроцитарные изменения, включая повреждение цитоскелета, мембранных белков, индуцирует образование метгемоглобина и способствует активации различных протеаз [24]. Кроме того, под действием пероксинитрита происходит экспонирование фосфатидилсерина на наружном слое мембраны эритроцита [24]. Пероксинитрит индуцирует фосфорилирование тирозина белка 3 полосы и одновременно ингибирует активность мембраносвязанного белка, фосфотирозинфосфатазы. Результатом этих параллельных эффектов пероксинитрита является активация гликолиза [17]. Помимо пероксинитрита феномен индукции апоптоза эритроцитов был показан для гидроксильных радикалов [25].
От окислительного стресса эритроциты защищают мембраносвязанные протеиназы, ферменты АОЗ и другие белки [7]. В настоящее время большое внимание уделяется изучению белка пероксиредоксин 2 (Prx2), как одному из важнейших белков антиоксидантной защиты эритроцитов. Prx2 – это тиол-зависимая пероксидаза. В комбинации с каталазой и глутатионпероксидазой Prx2 составляют эффективную систему для утилизации пероксида водорода, образующегося в низких концентрациях при аутоокислении гемоглобина. Восстановленная форма пероксиредоксина поддерживается тиоредоксинредуктазой, но активность последней достаточно низкая. Prx2 обладает высокой чувствительностью к окислению пероксидом водорода. Предложена модель каталитического цикла Prx2, состоящая из трех стадий. Интересно отметить, что этот цикл требует 2 конформационных состояния: полный фолдинг с формированием активного центра и локальный дефолдинговая форма, которая требуется для восстановления Prx2 [18]. Помимо функции некаталитического скэвэнджера пероксида водорода пероксиредоксин регулирует трaнcпорт ионов, связываясь с мембраной эритроцита и активируя Gárdos каналы, но механизм этого процесса пока не ясен [18, 19]. Увеличение внутриклеточного пероксида водорода приводит к увеличению доли мембраносвязанного гемоглобина и активации перекисного окисления липидов. Связывание Prx2 с мембраной также возрастало при увеличении концентрации пероксида водорода. Значение этого явления ясно не до конца. Тем не менее, по мнению авторов, хотя рост мембраносвязанного гемоглобина и мембраносвязанного Prx2 являются двумя независимыми процессами, но оба этих события являются маркерами окислительного стресса эритроцитов [23, 32].
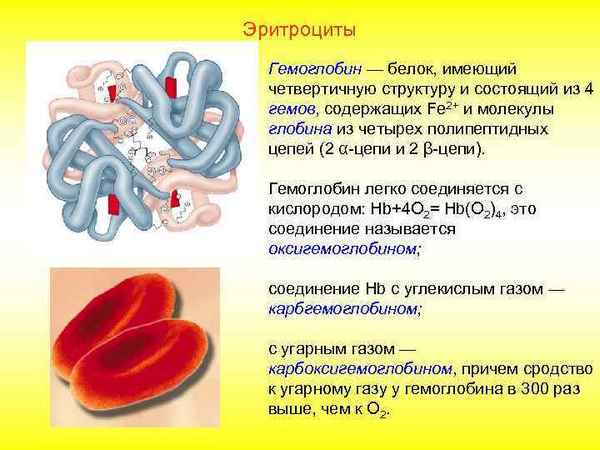
Появились новые данные о локализации гемоглобина внутри эритроцита. Согласно Brazhe NA и соавт. существует 2 популяции гемоглобина в эритроцитах: субмембранная и цитозольная. При этом конформация молекул субмембранного гемоглобина отличается от таковой цитозольной фpaкции [5]. Требуется дальнейшие исследования этого феномена. Расширены представления об аллостерических регуляторах связывания кислорода с гемоглобином. По мнению Mairbäurl и Weber, регуляция обусловлена изменениями таких аллостерических эффекторов как протоны (H+), двуокись углерода (CO2), органические фосфаты и хлориды (Cl−) [20].
Большой интерес представляет обсуждение вопроса о роли гемоглобина в старении эритроцитов. Показано, что стареющие эритроциты аккумулируют окислительно -денатурированный гемоглобин, переокисленные липиды, высокомолекулярные агрегаты белки, теряют сиаловые кислоты. Эти процессы ведут к снижению фосфолипидной симметрии, образованию перекрестных связей спектрин-гемоглобин, агрегацию белка 3 полосы, увеличение гликированных конечных продуктов. Предположено, что взаимодействие гемоглобина, особенно, в условиях гипоксии с белком 3 полосы мембраны эритроцитов является критичным для изменения мембраны эритроцитов, что в свою очередь, является триггерным механизмом для удаления клеток из гемоциркуляции. Эти перестройки мембраны включают экспозицию антигенных сайтов, увеличение захода кальция в эритроциты, утечку калия из эритроцитов, что приводит к сморщиванию клеток и потерю деформабильности. Нерешенной проблемой является вероятное окислительное повреждение специфических белков мембран при окислительно-восстановительных реакциях, которые имеют место при связывании гемоглобина с мембраной [7; 32]. Дальнейшие протеомные исследования могут выявить специфические белки, участвующие в механизмах старения эритроцитов.
Имеются фактические данные о развитии апоптоза эритроцитов. В обзоре [1] приведено достаточно подробное описание сигнальных путей включения апоптоза красных клеток. Согласно [1], первый путь связан с активацией циклооксигеназы, образованием простагландина Е2 и формированием катионных каналов. Второй путь связан с каскадной активацией сфингомиелиназы. Кроме того, процесс апоптоза эритроцитов может быть индуцирован пероксинитритом [1, 24], гидроксильными радикалами [25], а также метгемоглобином [1]. Также приведены результаты исследования, демонстрирующие взаимосвязь между изменением деформационных свойств мембран эритроцитов и запуском программы апоптоза [1].
Таким образом, накоплены данные, расширяющие представления о метаболических процессах в эритроцитах. В перспективе эти результаты могут быть использованы при интерпретации и прогнозирования изменения структуры и функций эритроцитов при различных патологических состояниях.
 Статья в формате PDF
128 KB...
Статья в формате PDF
128 KB...
24 04 2024 17:49:17
 Статья в формате PDF
122 KB...
Статья в формате PDF
122 KB...
23 04 2024 23:26:46
 Статья в формате PDF
297 KB...
Статья в формате PDF
297 KB...
22 04 2024 8:15:12
 Статья в формате PDF
101 KB...
Статья в формате PDF
101 KB...
21 04 2024 10:58:21
 Статья в формате PDF
116 KB...
Статья в формате PDF
116 KB...
20 04 2024 21:31:30
 Статья в формате PDF
314 KB...
Статья в формате PDF
314 KB...
18 04 2024 11:59:17
17 04 2024 5:19:55
 Статья в формате PDF
110 KB...
Статья в формате PDF
110 KB...
15 04 2024 9:39:22
14 04 2024 20:47:26
 Статья в формате PDF
119 KB...
Статья в формате PDF
119 KB...
13 04 2024 17:28:40
 Статья в формате PDF
226 KB...
Статья в формате PDF
226 KB...
12 04 2024 21:19:35
 Статья в формате PDF
120 KB...
Статья в формате PDF
120 KB...
10 04 2024 12:42:25
09 04 2024 4:36:41
 Испытан способ стимуляции костномозгового гемопоэза при лечении острой лучевой болезни (ОЛБ) у животных, включающий остеоперфорацию эпифизов трубчатых костей, с использованием высокоинтенсивного инфpaкрасного диодного лазера.
После остеоперфорации проводится курс лечения церулоплазмином в суточной дозе 1,5-2,5 мг/кг.
Проведенные экспериментальные исследования и наблюдения показывают, что на фоне лазерной остеоперфорации и применения церулоплазмина у собак отмечено интенсивное увеличение содержания в периферической крови эритроцитов, гемоглобина, лейкоцитов, а также концентрации гемоглобина в одном эритроците.
Эффективность при лечении острой лучевой болезни составила 100%.
...
Испытан способ стимуляции костномозгового гемопоэза при лечении острой лучевой болезни (ОЛБ) у животных, включающий остеоперфорацию эпифизов трубчатых костей, с использованием высокоинтенсивного инфpaкрасного диодного лазера.
После остеоперфорации проводится курс лечения церулоплазмином в суточной дозе 1,5-2,5 мг/кг.
Проведенные экспериментальные исследования и наблюдения показывают, что на фоне лазерной остеоперфорации и применения церулоплазмина у собак отмечено интенсивное увеличение содержания в периферической крови эритроцитов, гемоглобина, лейкоцитов, а также концентрации гемоглобина в одном эритроците.
Эффективность при лечении острой лучевой болезни составила 100%.
...
08 04 2024 13:14:44
 Статья в формате PDF
129 KB...
Статья в формате PDF
129 KB...
07 04 2024 5:45:53
 Статья в формате PDF
271 KB...
Статья в формате PDF
271 KB...
06 04 2024 10:49:27
 Статья в формате PDF
100 KB...
Статья в формате PDF
100 KB...
05 04 2024 23:47:34
 Статья в формате PDF
121 KB...
Статья в формате PDF
121 KB...
04 04 2024 16:59:51
 Рассмотрена современная классификация и номенклатура пробиотических средств. Проведен анализ по составу и форме выпуска препаратов, представленных на российском фармацевтическом рынке. Даны рекомендации по оптимальному дозированию препаратов пробиотиков и повышению их устойчивости с помощью метода иммобилизации.
...
Рассмотрена современная классификация и номенклатура пробиотических средств. Проведен анализ по составу и форме выпуска препаратов, представленных на российском фармацевтическом рынке. Даны рекомендации по оптимальному дозированию препаратов пробиотиков и повышению их устойчивости с помощью метода иммобилизации.
...
03 04 2024 18:59:16
 Статья в формате PDF
254 KB...
Статья в формате PDF
254 KB...
02 04 2024 18:54:23
 Статья в формате PDF
269 KB...
Статья в формате PDF
269 KB...
01 04 2024 19:52:21
 Статья в формате PDF
115 KB...
Статья в формате PDF
115 KB...
31 03 2024 19:41:20
 В статье рассматривается вопрос долговременного архивного хранения угасающих документов. Проанализированы сложности, возникающие при их микрофильмировании. Предложена методика предварительной компьютерной обработки сканированных изображений таких документов, обеспечивающая повышение качества их визуального восприятия до требований государственного стандарта к микрофильмируемым оригиналам. Обработанные изображения в дальнейшем могут быть выведены на фотоплёнку с использованием COM-систем (Computer Output Microfilm), либо распечатаны на бумажный носитель и микрофильмированы обычным способом.
...
В статье рассматривается вопрос долговременного архивного хранения угасающих документов. Проанализированы сложности, возникающие при их микрофильмировании. Предложена методика предварительной компьютерной обработки сканированных изображений таких документов, обеспечивающая повышение качества их визуального восприятия до требований государственного стандарта к микрофильмируемым оригиналам. Обработанные изображения в дальнейшем могут быть выведены на фотоплёнку с использованием COM-систем (Computer Output Microfilm), либо распечатаны на бумажный носитель и микрофильмированы обычным способом.
...
30 03 2024 11:39:38
 Статья в формате PDF
107 KB...
Статья в формате PDF
107 KB...
29 03 2024 6:51:13
 В статье приведен комплексный анализ антропогенного воздействия на природную среду Иркутской области, приводящего к изменению не только количественных, но и качественных хаpaктеристик природной среды как системы. В частности, приведена общая экологическая ситуация, указывающая на значительное загрязнение и качественные изменения во всех компонентах окружающей среды: в почве, атмосферном воздухе, водных ресурсах. Комплексная химическая нагрузка влияет также на медико-демографические показатели здоровья населения. Необходим переход от технократического подхода к технологическому, что позволит избежать дальнейшей деградации природной системы. В качестве универсальной, независимой от экономической ситуации, единицы оценки экологического риска предложено использовать время. Основанная на современных представлениях о времени технология позволит установить границы антропогенного воздействия на природную систему, а так же рассчитать предполагаемый ущерб, наносимый природной системе каким-либо видом воздействия, выявить области с наложением различных типов воздействий, рассчитать совокупный ущерб в границах таких областей, и, следовательно, разработать комплекс превентивных мер для исключения качественных изменений природной среды.
...
В статье приведен комплексный анализ антропогенного воздействия на природную среду Иркутской области, приводящего к изменению не только количественных, но и качественных хаpaктеристик природной среды как системы. В частности, приведена общая экологическая ситуация, указывающая на значительное загрязнение и качественные изменения во всех компонентах окружающей среды: в почве, атмосферном воздухе, водных ресурсах. Комплексная химическая нагрузка влияет также на медико-демографические показатели здоровья населения. Необходим переход от технократического подхода к технологическому, что позволит избежать дальнейшей деградации природной системы. В качестве универсальной, независимой от экономической ситуации, единицы оценки экологического риска предложено использовать время. Основанная на современных представлениях о времени технология позволит установить границы антропогенного воздействия на природную систему, а так же рассчитать предполагаемый ущерб, наносимый природной системе каким-либо видом воздействия, выявить области с наложением различных типов воздействий, рассчитать совокупный ущерб в границах таких областей, и, следовательно, разработать комплекс превентивных мер для исключения качественных изменений природной среды.
...
27 03 2024 18:44:50
 Статья в формате PDF
114 KB...
Статья в формате PDF
114 KB...
25 03 2024 10:31:47
 Статья в формате PDF
116 KB...
Статья в формате PDF
116 KB...
24 03 2024 5:17:12
23 03 2024 3:12:33
 Статья в формате PDF
107 KB...
Статья в формате PDF
107 KB...
21 03 2024 9:54:53
 Статья в формате PDF
109 KB...
Статья в формате PDF
109 KB...
20 03 2024 18:17:21
 Статья в формате PDF
310 KB...
Статья в формате PDF
310 KB...
19 03 2024 9:59:42
 Проведено ретроспективное изучение историй болезней 71 пациента, оперированных по поводу закрытой травмы селезенки.Из общего количества оперированных пациентов спленэктомия была выполнена 25 пациентам, 26 – спленэктомия была дополнена аутолиентрaнcплантаций путем пересадки кусочков селезенки размером 1,5 см3 в ткань большого сальника, а 20 больным были выполнены органосохраняющие операции с использованием лазерной техники. Изучение исследуемых показателей проводили в момент поступления больных, на первые, третьи, пятые, седьмые и десятые послеоперационные сутки. Группу сравнения составили 46 относительно здоровых добровольцев того же возраста и пола. Лейкоцитарный индекс интоксикации рассчитывали по формуле предложенной В.К. Островским и Ю.М. Свитич. Кроме того определялись лейкоцитарный индекс интоксикации по индексу Я.Я. Кальф-Калифа, а так же индекс резистентности организма и индекс сдвига лейкоцитов крови. В результате проведенного исследования установлено, чтоизменения индексов хаpaктеризующих резистентность организма, у пациентов оперированных на поврежденной селезенке, в ближайшем послеоперационном периоде зависят не от хаpaктера выполненной операции, а от послеоперационных суток. В тоже время в отдаленном послеоперационном природе прослеживается взаимосвязь между хаpaктером выполненной операции и изменениями индексов хаpaктеризующих резистентность организма.
...
Проведено ретроспективное изучение историй болезней 71 пациента, оперированных по поводу закрытой травмы селезенки.Из общего количества оперированных пациентов спленэктомия была выполнена 25 пациентам, 26 – спленэктомия была дополнена аутолиентрaнcплантаций путем пересадки кусочков селезенки размером 1,5 см3 в ткань большого сальника, а 20 больным были выполнены органосохраняющие операции с использованием лазерной техники. Изучение исследуемых показателей проводили в момент поступления больных, на первые, третьи, пятые, седьмые и десятые послеоперационные сутки. Группу сравнения составили 46 относительно здоровых добровольцев того же возраста и пола. Лейкоцитарный индекс интоксикации рассчитывали по формуле предложенной В.К. Островским и Ю.М. Свитич. Кроме того определялись лейкоцитарный индекс интоксикации по индексу Я.Я. Кальф-Калифа, а так же индекс резистентности организма и индекс сдвига лейкоцитов крови. В результате проведенного исследования установлено, чтоизменения индексов хаpaктеризующих резистентность организма, у пациентов оперированных на поврежденной селезенке, в ближайшем послеоперационном периоде зависят не от хаpaктера выполненной операции, а от послеоперационных суток. В тоже время в отдаленном послеоперационном природе прослеживается взаимосвязь между хаpaктером выполненной операции и изменениями индексов хаpaктеризующих резистентность организма.
...
18 03 2024 3:14:41
Еще:
Поддержать себя -1 :: Поддержать себя -2 :: Поддержать себя -3 :: Поддержать себя -4 :: Поддержать себя -5 :: Поддержать себя -6 :: Поддержать себя -7 :: Поддержать себя -8 :: Поддержать себя -9 :: Поддержать себя -10 :: Поддержать себя -11 :: Поддержать себя -12 :: Поддержать себя -13 :: Поддержать себя -14 :: Поддержать себя -15 :: Поддержать себя -16 :: Поддержать себя -17 :: Поддержать себя -18 :: Поддержать себя -19 :: Поддержать себя -20 :: Поддержать себя -21 :: Поддержать себя -22 :: Поддержать себя -23 :: Поддержать себя -24 :: Поддержать себя -25 :: Поддержать себя -26 :: Поддержать себя -27 :: Поддержать себя -28 :: Поддержать себя -29 :: Поддержать себя -30 :: Поддержать себя -31 :: Поддержать себя -32 :: Поддержать себя -33 :: Поддержать себя -34 :: Поддержать себя -35 :: Поддержать себя -36 :: Поддержать себя -37 :: Поддержать себя -38 ::